IPTG (isopropyl-β-D-thiogalactoside) เป็นอะนาล็อกของสารตั้งต้น β-galactosidase ซึ่งเหนี่ยวนำได้สูงภายใต้การเหนี่ยวนำของ IPTG ตัวเหนี่ยวนำสามารถสร้างคอมเพล็กซ์กับโปรตีนเพรสเซอร์ เพื่อให้โครงสร้างของโปรตีนเพรสเซอร์เปลี่ยนไป ดังนั้นจึงไม่สามารถรวมกับยีนเป้าหมายได้ และยีนเป้าหมายจะแสดงออกอย่างมีประสิทธิภาพแล้วความเข้มข้นของ IPTG จะถูกกำหนดอย่างไรในระหว่างการทดลอง?ยิ่งโตยิ่งดี?
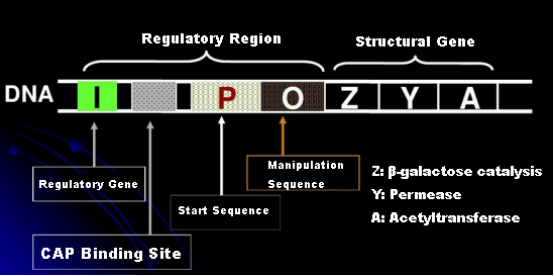
ก่อนอื่น มาทำความเข้าใจหลักการของการเหนี่ยวนำ IPTG: แลคโตสโอเปอเรชัน (องค์ประกอบ) ของ E. coli ประกอบด้วยยีนโครงสร้างสามยีน ได้แก่ Z, Y และ A ซึ่งเข้ารหัส β-galactosidase, permease และ acetyltransferase ตามลำดับlacZ ไฮโดรไลซ์แลคโตสเป็นกลูโคสและกาแลคโตสหรือเป็นอัลโลแลคโตสlacY ช่วยให้แลคโตสในสิ่งแวดล้อมผ่านเยื่อหุ้มเซลล์และเข้าสู่เซลล์lacA ถ่ายโอนหมู่ acetyl จาก acetyl-CoA ไปยัง β-galactoside ซึ่งเกี่ยวข้องกับการกำจัดพิษนอกจากนี้ ยังมีลำดับปฏิบัติการ O, ลำดับเริ่มต้น P และยีนควบคุม I รหัสยีน I เป็นโปรตีนตัวกดที่สามารถจับกับตำแหน่ง O ของลำดับตัวดำเนินการ เพื่อให้ตัวดำเนินการ (เมตา) ถูกกดและ ปิด.นอกจากนี้ยังมีตำแหน่งการจับสำหรับตำแหน่งจับโปรตีน-CAP ของยีนกระตุ้นแคตาบอลิกที่ต้นน้ำของลำดับเริ่มต้น P ลำดับ P, ลำดับ O และตำแหน่งการจับ CAP รวมกันเป็นเขตควบคุมของครั่งโอเปอเรเตอร์ยีนเข้ารหัสของเอนไซม์ทั้งสามถูกควบคุมโดยเขตควบคุมเดียวกันเพื่อให้ได้การแสดงออกที่สอดคล้องกันของผลิตภัณฑ์ยีน
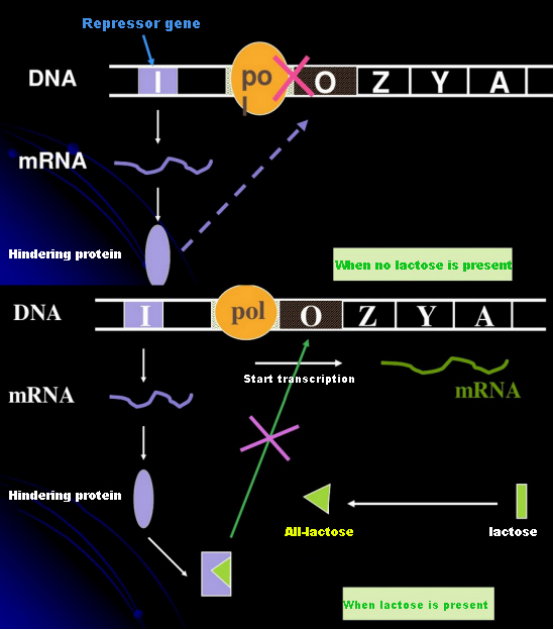
ในกรณีที่ไม่มีแลคโตส ครั่งโอเปอรอน (เมตา) จะอยู่ในสภาวะกดขี่ในเวลานี้ ครั่งรีเพรสเซอร์ที่แสดงออกโดยลำดับ I ภายใต้การควบคุมของลำดับโปรโมเตอร์ PI จับกับลำดับ O ซึ่งป้องกัน RNA polymerase จากการจับกับลำดับ P และยับยั้งการเริ่มต้นการถอดรหัสเมื่อมีแลคโตส สามารถเหนี่ยวนำให้เกิดครั่งโอเปอรอน (เมตา) ได้ ในระบบโอเปอรอน (เมตา) นี้ ตัวเหนี่ยวนำที่แท้จริงไม่ใช่แลคโตสแลคโตสเข้าสู่เซลล์และถูกเร่งปฏิกิริยาโดย β-galactosidase เพื่อเปลี่ยนเป็นอัลลอแลคโตสอย่างหลัง ในฐานะโมเลกุลเหนี่ยวนำ จับกับโปรตีนเพรสเซอร์และเปลี่ยนโครงสร้างโปรตีน ซึ่งนำไปสู่การแยกตัวของโปรตีนเพรสเซอร์จากลำดับ O และการถอดรหัสIsopropylthiogalactoside (IPTG) มีผลเช่นเดียวกับอัลโลแลคโตสเป็นตัวเหนี่ยวนำที่ทรงพลังมากซึ่งไม่ถูกเผาผลาญโดยแบคทีเรียและมีความเสถียรมาก ดังนั้นจึงใช้กันอย่างแพร่หลายในห้องปฏิบัติการ
จะกำหนดความเข้มข้นที่เหมาะสมของ IPTG ได้อย่างไร?ใช้ E. coli เป็นตัวอย่าง
สายพันธุ์ที่ดัดแปลงพันธุกรรมของ E. coli BL21 ที่มี recombinant pGEX (CGRP/msCT) ที่เป็นบวกถูกฉีดเข้าไปในอาหารเลี้ยงเชื้อ LB ที่มี 50μg·mL-1 Amp และเพาะเลี้ยงข้ามคืนที่ 37°Cเพาะเชื้อข้างต้นลงในขวดอาหารเหลว LB สดขนาด 50 มล. 10 ขวดที่มีแอมป์ 50μg·mL-1 ในอัตราส่วน 1:100 สำหรับการเพาะเลี้ยงขยาย และเมื่อค่า OD600 เป็น 0.6~0.8 IPTG จะถูกเพิ่มลงในความเข้มข้นสุดท้ายมันคือ 0.1, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7, 0.8, 0.9, 1.0mmol·L-1หลังจากการเหนี่ยวนำที่อุณหภูมิเดียวกันและเวลาเดียวกัน สารละลายแบคทีเรีย 1 มล. ถูกนำมาจากสารละลายนั้น และเซลล์แบคทีเรียถูกรวบรวมโดยการหมุนเหวี่ยงและอยู่ภายใต้ SDS-PAGE เพื่อวิเคราะห์อิทธิพลของความเข้มข้นของ IPTG ที่แตกต่างกันต่อการแสดงออกของโปรตีน จากนั้น เลือกความเข้มข้นของ IPTG ที่มีการแสดงออกของโปรตีนที่ใหญ่ที่สุด
หลังจากทดลองแล้วจะพบว่าความเข้มข้นของ IPTG มีไม่มากเท่าที่จะเป็นไปได้เนื่องจาก IPTG มีความเป็นพิษต่อแบคทีเรียความเข้มข้นที่มากเกินไปจะทำให้เซลล์ตายด้วยและโดยทั่วไปแล้ว เราหวังว่ายิ่งแสดงโปรตีนที่ละลายน้ำได้ในเซลล์มากเท่าไหร่ก็ยิ่งดีเท่านั้น แต่ในหลายกรณีเมื่อความเข้มข้นของ IPTG สูงเกินไป ก็จะเกิดการรวมตัวจำนวนมากขึ้นร่างกายแต่ปริมาณโปรตีนที่ละลายน้ำได้ลดลงดังนั้นความเข้มข้นของ IPTG ที่เหมาะสมที่สุดมักไม่ยิ่งมากยิ่งดี แต่ยิ่งมีความเข้มข้นต่ำ
วัตถุประสงค์ของการเหนี่ยวนำและการเพาะเลี้ยงสายพันธุ์ดัดแปลงพันธุกรรมคือการเพิ่มผลผลิตของโปรตีนเป้าหมายและลดต้นทุนการแสดงออกของยีนเป้าหมายไม่เพียงแต่ได้รับผลกระทบจากปัจจัยของสายพันธุ์เองและการแสดงออกของพลาสมิดเท่านั้น แต่ยังได้รับผลกระทบจากสภาวะภายนอกอื่นๆ เช่น ความเข้มข้นของตัวเหนี่ยวนำ อุณหภูมิเหนี่ยวนำ และเวลาเหนี่ยวนำดังนั้น โดยทั่วไปแล้ว ก่อนที่โปรตีนที่ไม่รู้จักจะถูกทำให้บริสุทธิ์และทำให้บริสุทธิ์ ควรศึกษาเวลาในการเหนี่ยวนำ อุณหภูมิ และความเข้มข้นของ IPTG เพื่อเลือกสภาวะที่เหมาะสมและได้ผลการทดลองที่ดีที่สุด
เวลาโพสต์: 31 ธ.ค.-2564

