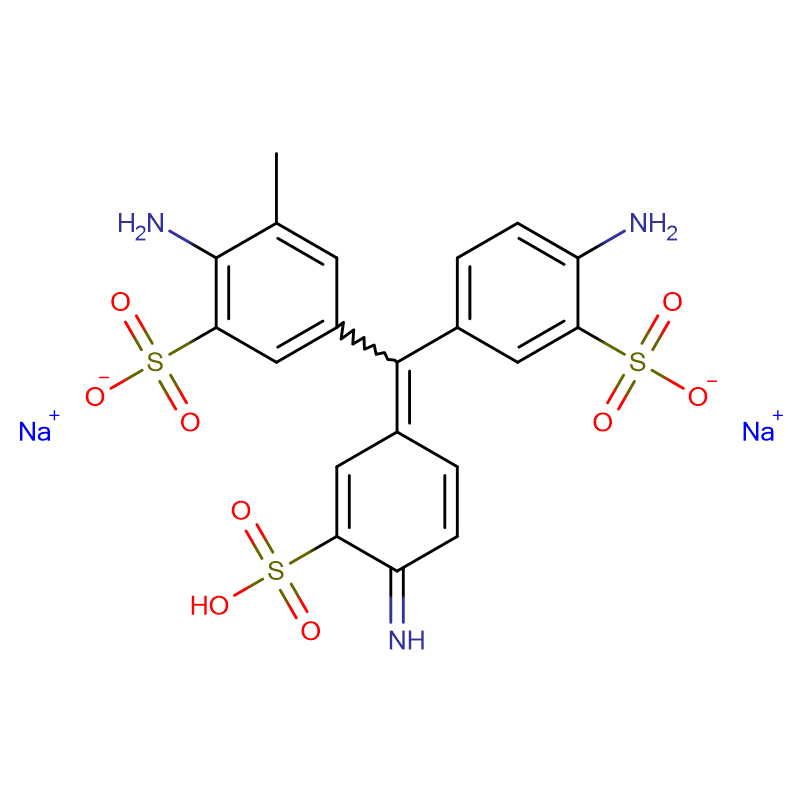
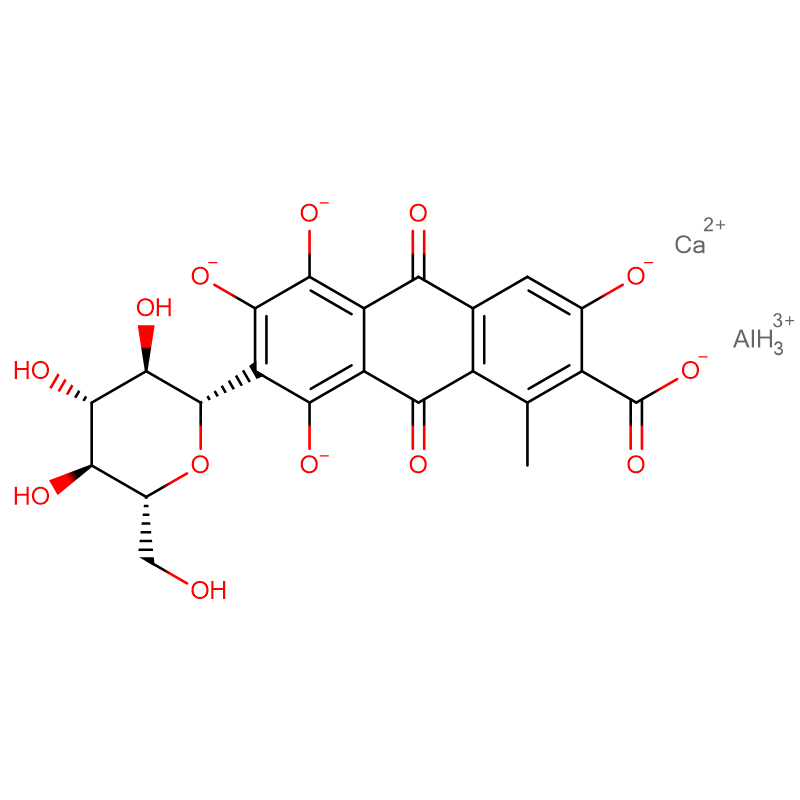
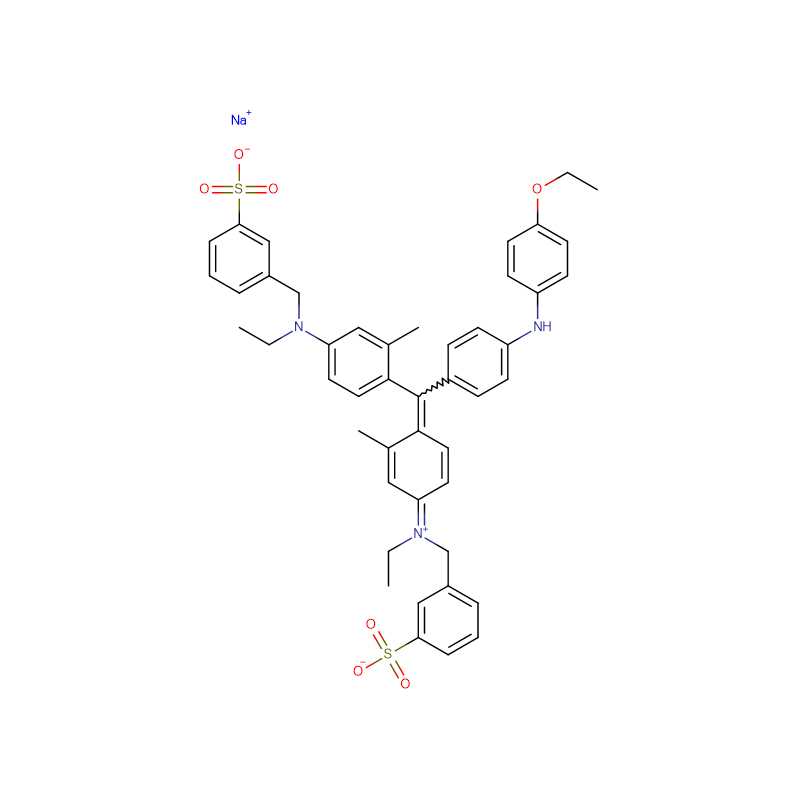
กรดฟุคซิน CAS:3244-88-0
| หมายเลขแคตตาล็อก | XD90488 |
| ชื่อผลิตภัณฑ์ | กรดฟุคซิน |
| CAS | 3244-88-0 |
| สูตรโมเลกุล | C20H20N2O9S3 |
| น้ำหนักโมเลกุล | 585.5382 |
| รายละเอียดการจัดเก็บ | สภาพแวดล้อม |
| รหัสภาษีที่สอดคล้องกัน | 32129000 |
คุณสมบัติของผลิตภัณฑ์
| รูปร่าง | ผงผลึกสีเขียวเข้ม |
| การทดสอบ | 70% |
| ปริมาณน้ำ | สูงสุด 10.0% |
| ความสามารถในการละลาย | น้ำยาใสไม่มีอนุภาค |
| ความแข็งแกร่ง | ขั้นต่ำ 100% |
| ไม่ละลายน้ำ | สูงสุด 0.2% |
Islet amyloid polypeptide (IAPP; หรือที่เรียกว่า amylin) มีหน้าที่สร้าง islet amyloid ในเบาหวานชนิดที่ 2 และเชื่อว่าความเป็นพิษที่เกิดจาก IAPP มีส่วนทำให้สูญเสียมวลเซลล์ β ที่เกี่ยวข้องกับระยะสุดท้ายของเบาหวานชนิดที่ 2การก่อตัวของไอส์เลตอะไมลอยด์อาจมีบทบาทในการรับสินบนล้มเหลวหลังการปลูกถ่ายIAPP ถูกผลิตขึ้นในรูปของฮอร์โมนโปร-ไอส์เลต อะไมลอยด์ โพลิเปปไทด์ (proIAPP) และถูกประมวลผลในแกรนูลที่คัดหลั่งของ β-เซลล์ของตับอ่อนรูปแบบการประมวลผลบางส่วนของ proIAPP พบได้ในแอมีลอยด์สะสม;สิ่งที่น่าสังเกตมากที่สุดคือ 48-residue intermediate, proIAPP(1-48) ซึ่งรวมถึงส่วนขยาย pro-terminal ของ N แต่ได้รับการประมวลผลอย่างเหมาะสมที่ปลาย Cการประมวลผลที่ไม่สมบูรณ์อาจมีบทบาทในการสร้างไอส์เลตอะไมลอยด์โดยส่งเสริมอันตรกิริยากับซัลเฟตโปรตีโอไกลแคนของเมทริกซ์นอกเซลล์ ซึ่งในทางกลับกัน ส่งเสริมการสร้างอะไมลอยด์เราแสดงว่ากรดฟุคซิน (3-(1-(4-amino-3-methyl-5-sulphonatophenyl)-1-(4-amino-3-sulphonatophenyl)methylene)cyclohexa-1,4-dienesulphonic acid) ที่เรียบง่าย อนุพันธ์ของซัลโฟเนเต็ด ไตรฟีนิล เมทิล เป็นตัวยับยั้งที่มีศักยภาพของการก่อตัวของแอมีลอยด์โดยสารมัธยันตร์ proIAPP(1-48)อนุพันธ์ของไตรฟีนิลมีเทนที่ซับซ้อนมากขึ้น FCF สีเขียวอย่างรวดเร็ว {เอทิล-[4-[[4-[เอทิล-[(3-sulfophenyl)เมทิล]อะมิโน]ฟีนิล]-(4-ไฮดรอกซี-2-ซัลโฟฟีนิล)เมทิลลิดีน]-1-ไซโคลเฮกซา -2,5-ไดไนลิดีน]-[(3-ซัลโฟฟีนิล)เมทิล]อะซาเนียม} ยังยับยั้งการก่อตัวของอะไมลอยด์โดย IAPP และโพรไอเอพีพีที่อยู่ระหว่างกระบวนการสารประกอบทั้งสองยับยั้งการสร้างแอมีลอยด์โดยของผสมระหว่างโพรไอเอพีพีและโมเดลไกลโคซามิโนไกลแคนเฮปาแรนซัลเฟตกรดฟุคซินยังยับยั้งการสร้างอะไมลอยด์ที่มีไกลโคซามิโนไกลแคนเป็นสื่อกลางโดย IAPP ที่โตเต็มที่ความสามารถในการยับยั้งการก่อตัวของแอมีลอยด์ไม่ได้เกิดจากสารประกอบที่เป็นซัลโฟเนเต็ดเพียงอย่างเดียว เนื่องจากตัวยับยั้งซัลโฟเนเต็ดของแอมีลอยด์-บีตา, ทรามิโปรเซต ไม่ใช่ตัวยับยั้งการก่อตัวของแอมีลอยด์โดย proIAPP(1-48)